Výrazně lehčí akumulátory by bylo možné zkonstruovat na základě elektrochemické reakce, které by se účastnil kyslík z atmosféry. Přes veškeré pokusy se takové zdroje proudu zatím příliš nerozšířily. Využití jinak v oblasti elektrochemických zdrojů proudu velmi rozšířeného lithia brání jeho reaktivita. Kromě kyslíku reaguje s vodní parou, oxidem uhličitým i dusíkem, jež v atmosféře rovněž nacházíme v nezanedbatelném množství. Dosavadní pokusy o sestrojení článku lithium - kyslík fungovaly dobře pouze v čistém kyslíku, nikoliv běžné atmosféře.
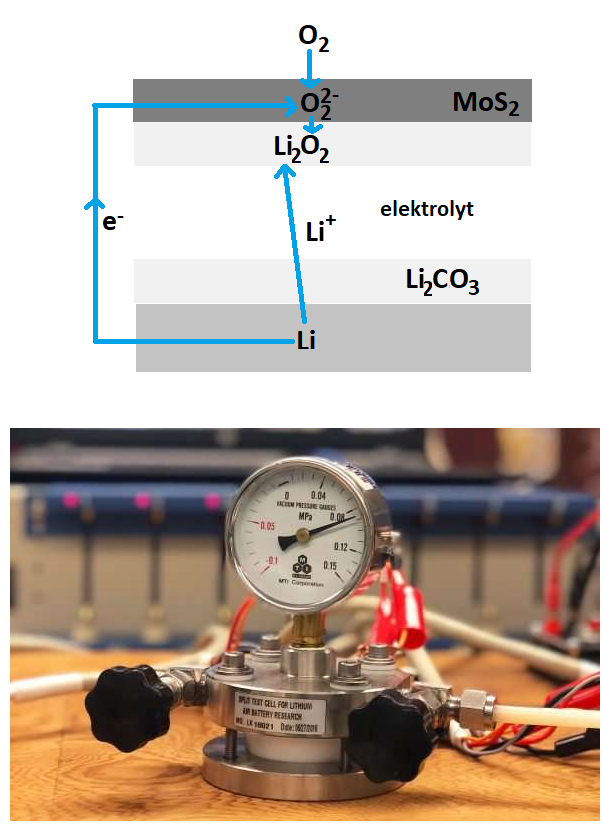
Zajímavé řešení problému představuje izolace lithiové anody vrstvou uhličitanu lithného Li2CO3, která dovoluje procházet jen lithným kationtům Li+. Na katodě ze sulfidu molybdeničitého MoS2 reagují se vzdušným kyslíkem na peroxid lithný Li2O2. Schéma vylepšeného elektrochemického článku lithium - kyslík při vybíjení vidíme nahoře na obrázku. Jako elektrolyt slouží roztok iontových kapalin v dimethylsulfoxidu.(CH3)2SO. Skutečný vzhled je v dolní části obrázku (foto Amin Salehi-Khojin, University of Illinois at Chicago).
“Úplná změna konstrukce spojená s redesignováním každé součásti umožnila, aby probíhaly žádoucí reakce a potlačila nechtěné, které nakonec akumulátor zničí,“ vysvětluje Amin Salehi-Khojin z University of Illinois at Chicago, šéf výzkumného týmu.
Franta Flinta 18.4.2018: Na obrázku je zřetelně vidět, že akumulátor nepracuje na vzduch, ale přivádějí mu plyn hadičkou z bomby.
19.4.2018: Na obrázku vidíme pokusný akumulátor. I když chceme, aby pracoval na vzduchu, musíme při jeho vývoji studovat, jak se chová při přesně definovaném složení plynné směsi, se kterou pracuje, a to včetně vlhkosti. To při práci se vzduchem zaručit nemůžeme. Navíc je šikovné podívat se, jak funguje při trochu jiném složení plynné směs než má vzduch.




